Энергия ионизации — это количество энергии, которое изолированный атом в основном электронном состоянии должен поглотить для освобождения электрона, в результате чего образуется ион.
Эта величина обычно выражается в кДж/моль или количество, необходимое для того, чтобы потерять один электрон.
Образование ионов
Ионы — это атомы, которые получили или потеряли электроны. Образуется ионизирующее излучение со своими положительными и отрицательными особенностями для человека. При рассмотрении первоначально нейтрального атома, вытеснение первого электрона потребует меньше работы, чем вытеснение второго, второй потребует меньше, чем третьего и так далее. Для вытеснение каждого последующего электрона требуется больше работы. Это происходит потому, что после потери первой отрицательно заряженной элементарной частицы общий заряд атома становится положительным, а отрицательные силы будут притягиваться к положительному заряду новообразованного иона.
При рассмотрении первоначально нейтрального атома, вытеснение первого электрона потребует меньше работы, чем вытеснение второго, второй потребует меньше, чем третьего и так далее. Для вытеснение каждого последующего электрона требуется больше работы. Это происходит потому, что после потери первой отрицательно заряженной элементарной частицы общий заряд атома становится положительным, а отрицательные силы будут притягиваться к положительному заряду новообразованного иона.
Чем больше отрицательно заряженных элементарных частиц потеряно, тем более положительным будет этот ион, тем труднее отделить другие электроны от этого атома.
В общем, чем дальше электрон от ядра, тем легче его изгнать. Другими словами, энергия ионизации является функцией атомного радиуса: чем больше радиус, тем меньше количество работы, необходимой для удаления электрона с внешней орбитали. Например, было бы гораздо легче забрать электроны от более крупного элемента Ca (кальция), чем от того, где они крепче удерживаются к ядру как Cl (хлор).
В химической реакции, [highlight]понимание энергии ионизации важно для того, чтобы понять поведение различных атомов при связях друг с другом[/highlight].
Например, энергия ионизации натрия (щелочного металла) составляет 496 кДж/моль, тогда как хлора — 1251,1 кДж/моль.
Элементы, находящиеся близко друг к другу в периодической таблице, или элементы, не имеющие большой разницы в энергии ионизации, образуют полярные ковалентные или ковалентные связи. Например, углерод и кислород делают СО2 (углекислый газ) находящиеся близко один к другому на периодической таблице. Они поэтому формируют ковалентное скрепление. Углерод и хлор образуют CCl4 (четыреххлористый углерод) другой молекулой, которая ковалентно связана.
Периодическая таблица и тренд ионизации
Энергия ионизации зависит от атомного радиуса. Так как идя справа налево по периодической таблице, атомный радиус увеличивается, а энергия ионизации уменьшается слева направо в периодах и вниз по группам.
Объяснение шаблона в первых нескольких элементах
Водород имеет электронную структуру 1s1. Это очень маленький атом, и электрон приближается к ядру и, следовательно, притягивает. Нет электронов, экранирующих его от ядра, поэтому энергия ионизации высока 1310 кДж моль-1.
Гелий имеет структуру 1s2. Электрон удаляется с той же орбиты, что и в случае с водородом он близок к ядру. Значение 2370 кДж моль-1 намного выше, чем у водорода, потому что ядро теперь имеет 2 протона, притягивающие их вместо 1.
Литий — 1s22s1. Свой внешний электрон находится на втором энергетическом уровне, гораздо более удаленнее от ядра. Можно утверждать, что это было бы компенсировано дополнительным протоном в ядре, но электрон не чувствует полной тяги ядра — он экранируется.
Если сравнить литий с водородом (а не с гелием), электрон водорода также чувствует тягу 1+ от ядра, но расстояние намного больше с литием. Первая энергия ионизации лития падает до 519 кДж моль-1, тогда как водород составляет 1310 кДж моль-1.
Исключения из этой тенденции наблюдаются для щелочноземельных металлов (группа 2: бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba), радий (Ra), унбинилий (Ubn) и элементов группы азота (группа 5: азот (N); фосфор (P); мышьяк (As); сурьма (Sb); висмут (Bi)). Группы 2 и 5 имеют полностью и наполовину заполненную электронную конфигурацию соответственно, поэтому для удаления отрицательно заряженных элементарных частиц из полностью заполненных орбиталей требуется больше работы, чем из неполнозаполненных.
Щелочные металлы (группа I) обладают малой энергией ионизации, особенно по сравнению с галогенами или группой VII.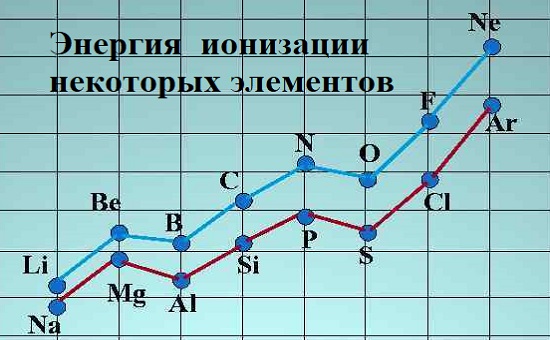
В дополнение к радиусу (расстоянию между ядром и электронами на самой внешней орбите), количество электронов между ядром, в самой внешней оболочке, также влияет на энергию ионизации.
Этот эффект, при котором полный положительный заряд ядра не ощущается внешними электронами из-за отрицательных зарядов внутренних, частично отменяющих положительный заряд, называется экранированием.
Чем больше электронов защищает внешнюю электронную оболочку от ядра, тем меньше работы требуется для вытеснения отрицательно заряженной элементарной частицы из указанного атома.
Чем выше эффект экранирования требуется меньше приложить работы. Из-за экранирующего эффекта энергия ионизации уменьшается сверху вниз в группе. Из таблицы Менделеева видно что Цезий имеет низкую, а фтор самую высокую энергию ионизации (за исключением гелия и неона).
Для чего необходимо знать про эту величину
Падение энергии ионизации при движении вниз таблицы приводит к снижению энергии активации и, следовательно, к более быстрым реакциям.
Энергия ионизации являются одним из наиболее важных факторов, которые необходимо учитывать при оценке прочности химических связей и прогнозировании того, как химические вещества будут связываться друг с другом. Но это не свободная энергия.


